
聯系創洋
電話:
021-66126658
021-66126659
盧總:
139-1700-9455
昆山電話:
0512-5759 1865
郵箱:
sy.lu@cy-water.com
地址:上海市普陀區曹楊路1700號辰金高尚領域T9幢308室
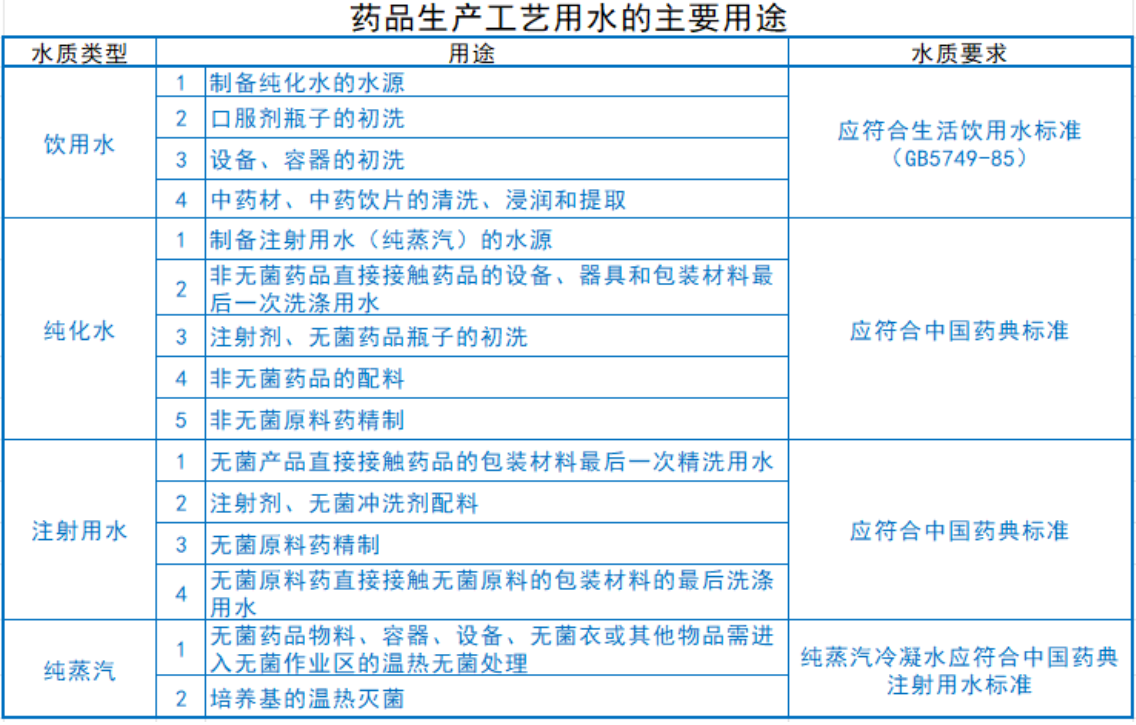
藥品生產企業GMP對工藝用水的要求
藥品生產企業中所使用的工藝用水主要指在制劑生產中進行洗瓶、配料等環節,以及在原料藥生產中的精制和清洗工序所需的水。為了避免與水的制造過程相關聯,應避免使用如去離子水、去鹽水和蒸餾水等名稱。相反,應從化學和微生物的角度,根據質量標準對水進行分類(例如,中國藥典規定純化水可采用三種不同的制備方法,未來可能會出現更優的制備技術)。
藥品生產GMP工藝用水的應用范圍
注射用水通常通過蒸餾法(也包括反滲透法和超濾法)從純化水制備而成,其化學純度高達99.999%,且不含熱原。由于純蒸汽的制備過程與利用蒸餾水制備注射用水的過程相似,因此可以使用同一臺多效蒸餾水機或獨立的純蒸汽發生器,因此將純蒸汽與注射用水一起進行討論。藥品生產工藝用水的具體用途見下表。
純化水和注射用水的水質標準。
純化水
在歐洲藥典中,可以選擇監測總有機碳(TOC)或易氧化物兩項中的任意一項。
美國藥典中規定如下:
企業自用的純化水需要監測其TOC和電導率,而商業用的純化水必須符合無菌純水的相關測試標準。表中列出了企業自用純化水的監測項目。
b.純化水不可用于制作腸外制劑。
微生物超標的糾正標準是指當微生物污染達到某個特定值時,表明純化水系統已經偏離了正常的運行狀態,此時需要采取糾正措施,以使系統恢復到正常的運行狀態。
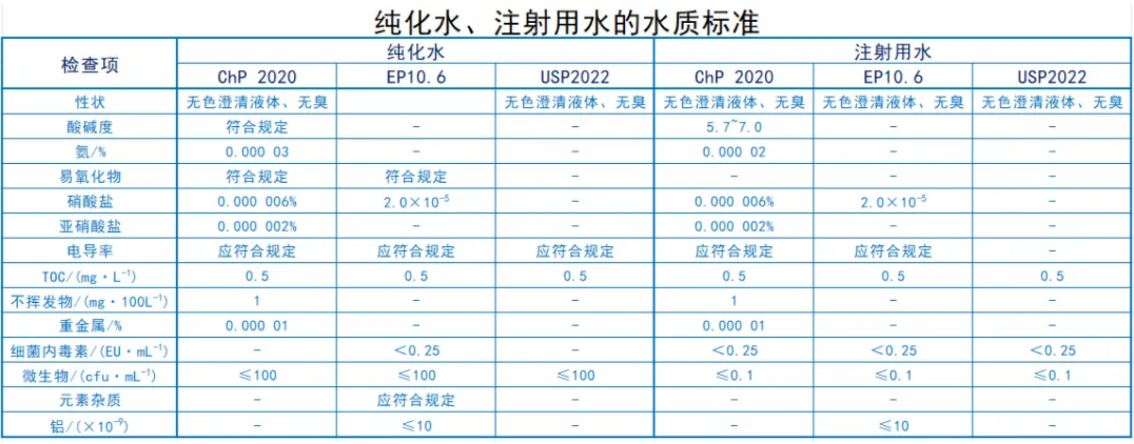
注射用水
在歐洲藥典中,可以選擇監測 TOC 或易氧化物中的任一項。
美國藥典規定,企業自用的注射用水(原料)需監測總有機碳(TOC)和電導率,而商業用的注射用水則必須符合無菌注射用水的測試要求。表中列出了企業自用注射用水的監測項目。
微生物超標糾正標準是指當微生物污染達到某個數值時,說明注射用水系統已經偏離了正常的運行狀態,此時需要采取糾正措施,以使系統恢復到正常的運行狀態。
01藥品生產企業GMP對工藝用水的要求
“熱原”通常指細菌產生的代謝產物,這些代謝產物能夠引起發熱,其含量可以用“細菌內霉素”這一指標來衡量。大多數細菌和許多霉菌都有產生熱的能力,其中革蘭陰性桿菌的熱原能力最為顯著。
微生物代謝產物中的內毒素是引起熱原反應的主要因素。細菌內毒素具有較強的耐熱性,其尺寸大約在1到50微米之間,因此可以通過普通濾器進入濾液中,但能夠被活性炭和硅藻土濾器等所吸附。
熱源本身不會揮發,但在蒸餾過程中,未汽化的水滴可能會將其帶入蒸餾水中。
02
總有機碳(TOC)等于總碳(TC)減去無機碳(IC)。
有機物都含有碳,因此在燃燒時會釋放出二氧化碳(CO2)。通過測定水中CO2的含量,可以間接反映水中有機碳的濃度,從而評估有機物的存在量,并驗證凈化設備和分配系統的有效性。測試方法是將有機分子完全氧化成等量的二氧化碳,并測量最終的CO2濃度,因此需要區分無機碳(IC)和樣品中分解出的有機碳。TOC的測定也可以通過TOC分析儀來完成,該儀器能夠同時測量溫度和電阻率。
總有機碳指標在一定程度上反映了水體污染的監測情況。多種有機污染物、微生物及細菌內毒素經過催化氧化后轉化為二氧化碳,從而改變水的電導率,而電導率的數值又可以換算為總有機碳的含量。如果總有機碳保持在較低水平,說明水中有機物、微生物和細菌內毒素的污染得到了較好的控制。這也是一些驗證資料中將總有機碳列為驗證項目的重要原因。
上一個: 注射用水系統中保溫/循環的方法
下一個: 醫療器械純化水檢驗項目及檢測步驟


